哺乳动物器官发生是一个奇妙的过程:在较短的时间内,三个胚层的细胞转化形成包含绝大部分内部和外部器官结构的胚胎。本研究中,作者通过 sci-RNA-seq3,对61个E9.5-13.5阶段的小鼠胚胎的约2百万个细胞进行单细胞转录组测序,获得小鼠器官发生图谱(MOCA),并利用 Monocle3,鉴定出上百种细胞亚型,56个轨迹以及对应的标志基因
Introduction
小鼠生长很快,从受精到出生仅需21天。从胚胎日起第4天(E4)发生囊胚植入,E6.5-E7.5原肠胚和胚层形成。在早期体节阶段,原肠胚过渡到早期器官发生,形成神经板和心管(E8.0-E8.5)。之后(E9.5-E13.5),胚胎从数万个细胞扩大到超过1000万个细胞,并发育出几乎所有主要的器官系统,因此这4天时间被广泛研究。事实上,绝大部分与重大发育缺陷相关的基因可以在该窗口期进行研究
单细胞转录组测序
为提升通量,作者对 sci-RNA-seq 实验技术进行了摸索和改进。sci-RNA-seq3相较之前的方法主要的提升有:
- 不用酶处理直接从新鲜组织提取细胞核,然后进行固定和保存
- 在第三级的索引,不使用 Tn5 tagmentaion,而是使用发夹结扎技术
- 对酶反应进行优化
- 用稀释法代替流式分选,并通过声波降解和过滤来减少细胞聚集
作者共收集了61个E9.5,E10.5,E11.5,E12.5或E13.5阶段的 C57BL/6 小鼠胚胎,液氮中快速冰冻,然后从胚胎中分离出细胞核,分别置于4个96孔板中。作为对照,在其中2个孔中加入人类 HEK-293T 和小鼠 NIH/3T3 的细胞核混合物。单细胞转录组文库通过单个 Illumina NovaSeq run 进行测序,最终得到110亿条reads(下图)
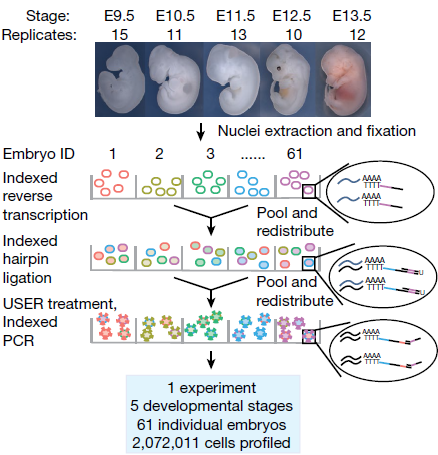
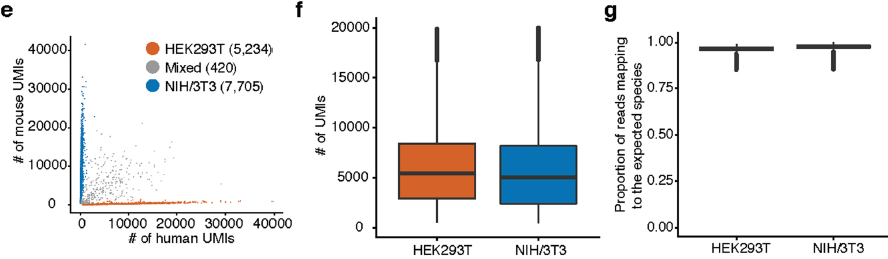
该实验中,共恢复出2,058,652个小鼠胚胎细胞和13,359个 HEK-293T or NIH/3T3 细胞(UMI计数≥200)。对照组孔中,来自人或小鼠的转录组表现出极高的物种一致性(即单个细胞中只含有人或小鼠的转录本),仅有3%(420/13359)出现冲突,与之前实验的表现相近(下图)。其中存在的一个缺陷是仅有约7%的细胞被测到,剩下大部分在过滤除去聚集的细胞核的过程中丢失了
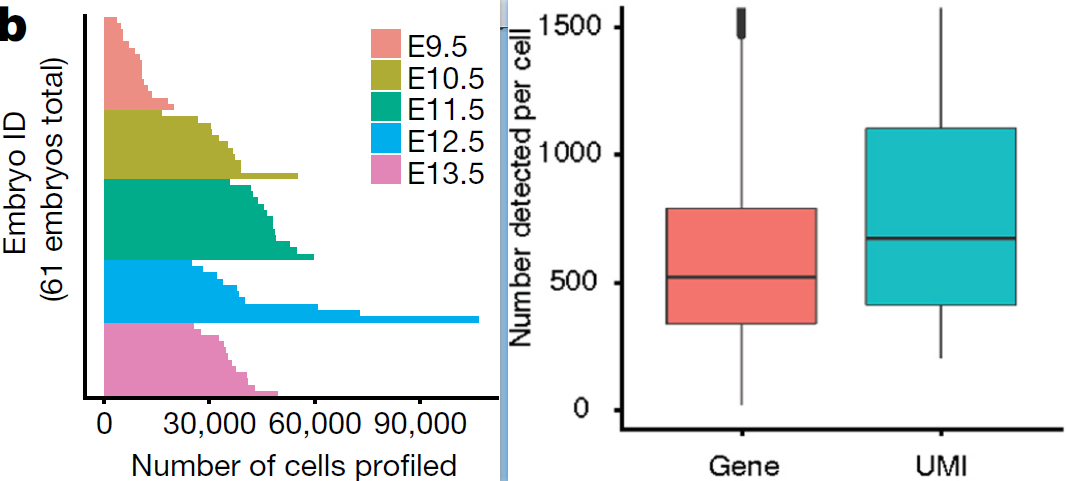
每个胚胎被测到的细胞中位数为35,272个(下图左),虽然测序深度较低(平均每个细胞5000条原始序列,46%的重复率),但每个细胞最终获得的 UMI 数量的中位数为671(519个基因)(下图右)。在部分孔中将测序深度提升至3.7倍后导致复杂程度也加倍(每个细胞 UMI 中位数为1142,87%的重复率)
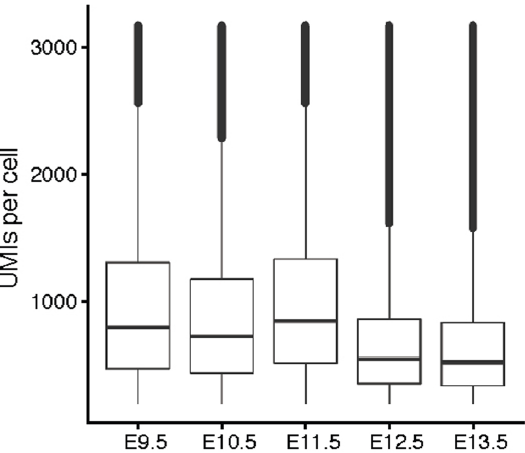
由于是对细胞核中的 RNA 进行测序,因此59%的 UMI 映射至内含子上,25%映射至外显子上,反映了早期的转录情况,虽然存在时间上的偏移,但也足够用于预测细胞中转录组的状态。处于晚期状态的胚胎 UMI 数量减少,可能反映了核中 mRNA 含量的减少(下图)。利用 Scrublet 检测到4.3%的细胞可能为 doublet
基于对不同时间点胚胎中细胞数量的粗略估计,可以估算出不同时间点胚胎的“细胞覆盖率”分别为0.8X(E9.5,每个胚胎200,000个细胞,总共获得152,000个该阶段的细胞),0.3X(E10.5,378000/1100000),0.2X(E11.5,616000/2600000),0.08X(E12.5,475000/6000000),0.03X(E13.5,437000/13000000)
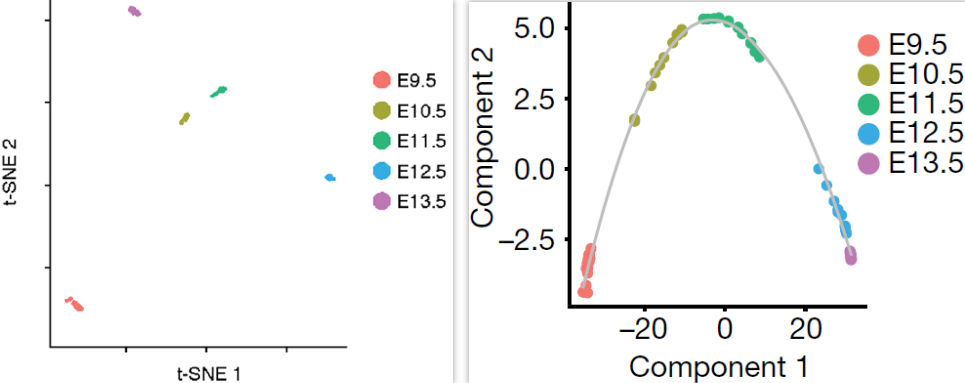
基于比对到 Xist 和 Y 染色体上的reads数量,能够很容易地将胚胎分为雄性(31)和雌性(30)。将各胚胎所有细胞的转录组整合获得整体的转录组,然后 t-SNE 可视化可以看到对应5个发育阶段的分支(下图左)。此外,对这些胚胎进行拟时序排列(下图右),发现 E9.5–E10.5 和 E11.5–E12.5 存在较大的空隙,表明这两个窗口期出现了特别显著的变化。基于这些“拟混池”数据,共鉴定出12,236个不同发育阶段差异表达的基因
细胞类型及亚型的鉴定
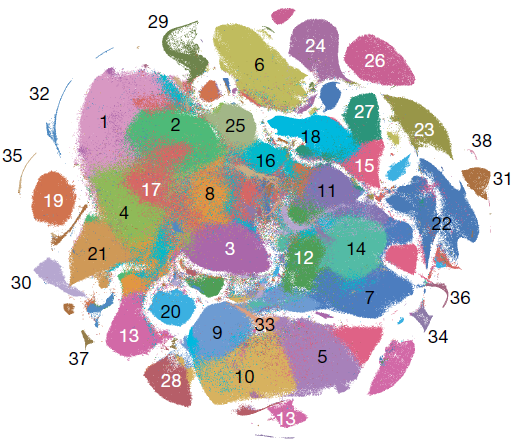
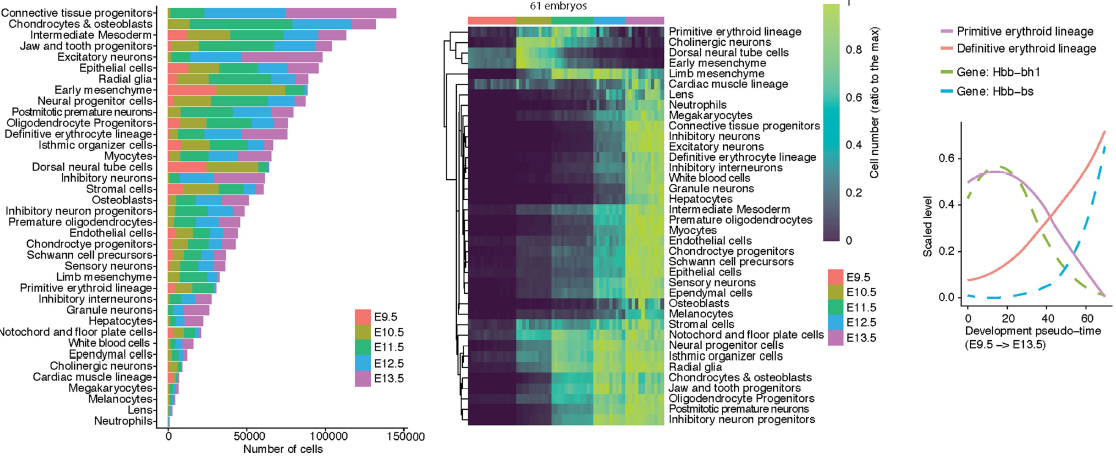
对2,058,652个细胞进行 Louvain 聚类以及 t-SNE 可视化,发现同一发育阶段的胚胎细胞分布类似,不同阶段的则不是。总计获得40个不同的分支,手动注释细胞类型。其中2个分支均对应 definitive erythroid lineage,因此将它们合并;另外有一个分支 doublet 率达52%,因此移除该分支,所以最终得到38个主要的分支(下图)
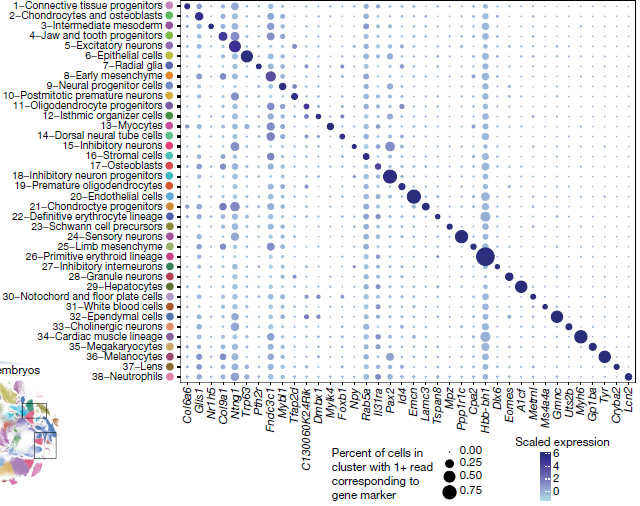
高度特异性的标志基因能够帮助注释细胞类型。下图为每一类型挑选出一个标志基因得到的可视化结果,点的大小对应该分支细胞中有多少检测到了该基因,颜色对应平均表达水平。可以看到大部分细胞类型特意表达标志基因,即便是小分支,也能够比较容易地注释。部分标志基因在多种细胞类型中均有出现,但是在某一分支中会高度表达。对应胚胎间质和结缔组织的分支的注释比较困难,因为已知的标志基因较少
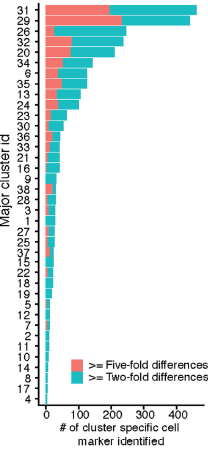
主要分支之间,68%的基因(17789/26183)存在差异表达,其中2863个基因为细胞类型特异性标志基因(定义为在表达最多和次多的细胞类型中的表达量相差2倍以上),平均每个每种类型细胞约75个(下图)。这些基因中的大部分之前未被认为是细胞类型标志基因,比如在脊索(分支30)中,Tox2,Stxbp6,Schip1,Spon1 等之前并未被认为是标志基因,但在本研究中是分支30的标志。
器官发生过程中,各类型细胞占比发生了明显的变化。大部分主要细胞类型呈指数增长,但有些细胞类型则是短暂出现,然后在E13.5消失(下图左和中)。例如在E9.5存在起源于卵黄囊(分支26,标志基因 Hbb-bh1)的 primitive erythroid lineage,但是来自胎儿肝脏(分支22,标志基因 Hbb-bs)的 definitive erythroid lineage 逐渐取代前者,最终成为E13.5时期唯一的红细胞系
38个主要细胞类型包含细胞数量的中位数为47,073,同一大类细胞之间也存在明显的异质性,因此对这些主要类型再一次进行 Louvain 聚类,移除那些1-2个胚胎却占据绝大部分的分支,并合并高度相似的分支,最终得到655个亚型(下图)。检测细胞类型及亚型的敏感性取决于本实验大量的细胞数目,降低取样后检测到的分支数减少
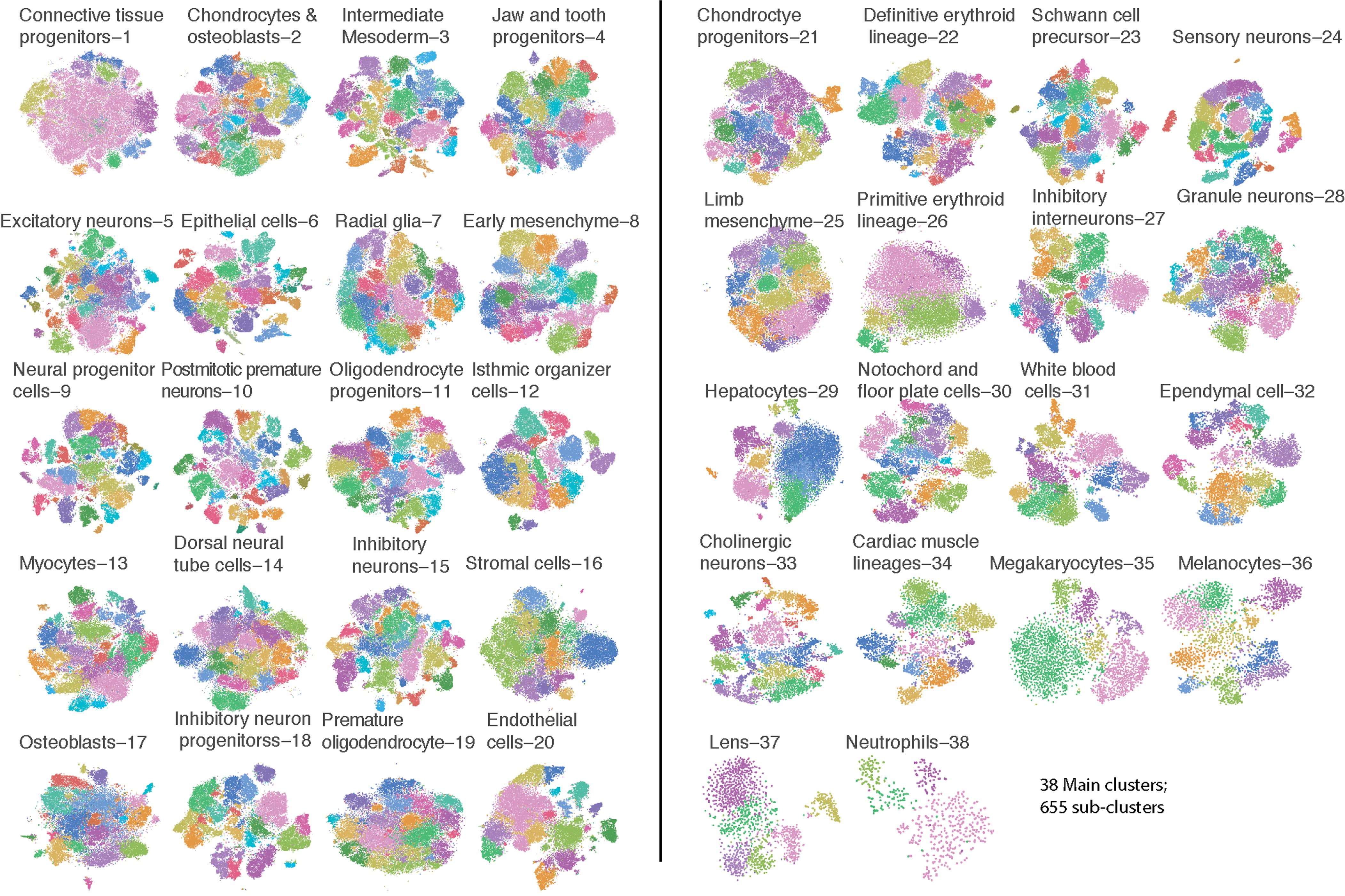
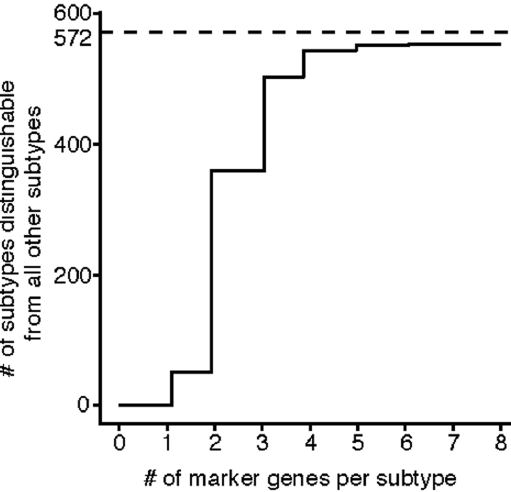
13%的亚型被认为可能是人为错误(这些分支中doublets超过10%)而剔除。剩下572个亚型,特异性标志基因(同一主细胞类型内,表达量最高和次高的亚型之间差异超过2倍)中位数为20。绝大部分亚型能够基于标志基因集与其他571个亚型区分开来,其中63%通过2个标志基因即可实现区分,95%通过4个标志基因可实现区分。下图显示用于区分亚型所需的标志基因数量
为了与其他细胞图谱进行区分,作者将该数据集命名为小鼠器官发生细胞图谱(mouse organogenesis cell atlases, MOCA)。将MOCA的细胞亚型与MCA中130个胎儿(E14.5)细胞类型比较,将96个MCA细胞类型与58个MOCA亚型对应。MOCA中无法与MCA对应的那些亚型多来自早期阶段(如神经管)或比较罕见(如晶状体),而MCA中无法与MOCA对应上的细胞主要是组织特异性免疫或上皮细胞,可能是E13.5之后才出现的。两个数据集之间可以相互印证:MCA中的解剖学信息可用于MOCA中亚型的定位,比如MOCA中一种内分泌上皮细胞亚分支对应MCA中位于胎儿胃部的腺泡和内分泌细胞;MOCA则可用于确定MCA中细胞的胚胎起源,例如MCA中定位于胎儿肾脏的处于细胞周期的细胞对应MOCA中过渡态中胚层的一个亚型,可能是肾脏的祖细胞。类似地,MOCA中的68个亚型与BCA中的48细胞类型对应
外胚层顶鞘的鉴定
作者对上皮细胞(分支6)(下图)所有的亚型进行了注释

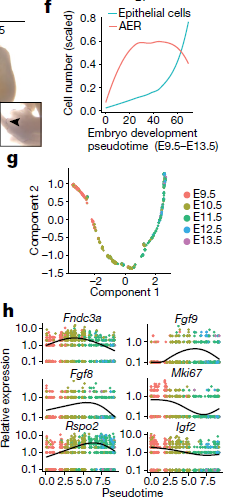
为了深入研究某一亚型,作者将目光聚焦到外胚层顶鞘(apical ectodermal ridge, AER)(亚型6.23)上,一类参与手指或足趾发育的高度特异性上皮细胞亚型。除了已知的标志基因外,本研究中还发现该亚型细胞可通过 Fndc3a,Adamts3,Slc16a10,Snap91 和 Pou6f2 的表达情况与其他亚型区分开来。WISH实验结果确认了 Fgf8(已知的标志基因),Fndc3a,Adamts3 和 Snap91 在腋芽最远端特异性表达,而该区域在E10.5或E11.5阶段对应AER(下图)
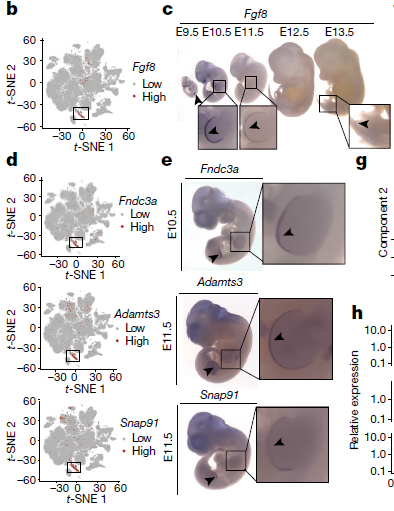
之后作者分析了AER增殖以及基因表达的动态过程。虽然在所有时间点以及几乎所有胚胎中都有测到,但是估算结果显示AER细胞数量在E10.5-E11.5之间达到峰值,与之前的报道相符。对AER细胞进行拟时间排序,得到一条简单的从早期到晚期的轨迹以及510个差异表达的基因。可以看到,像 Fgf8,Fgf939 和 Rspo234,活化过程后于 Fndc3a,Mik67 和 Igf2 等推动细胞增殖的基因的表达则是明显下降。通路层面的分析结果也显示该窗口期增殖相关程序下调
重构发育轨迹
之后作者探索器官发生过程中各类型细胞的发育轨迹。大部分现有的算法假设过程是连续的,但本研究是从E9.5起始的,不可避免地存在部分祖细胞或状态缺失的情况。此外,大部分算法也不允许出现细胞命运的收敛,但我们知道一些细胞类型可以通过不同的途径衍生而来。因此,作者开发了 Monocle3。Monocle3 首先通过 UMAP 将细胞映射至一个编码转录状态的低维空间,然后通过 Louvain community detection 算法将相似的细胞组合,然后将相近的组整合成“超组”,最后确定细胞发育过程中经过的路径或轨迹,分支的位置以及每个超组内的收敛性
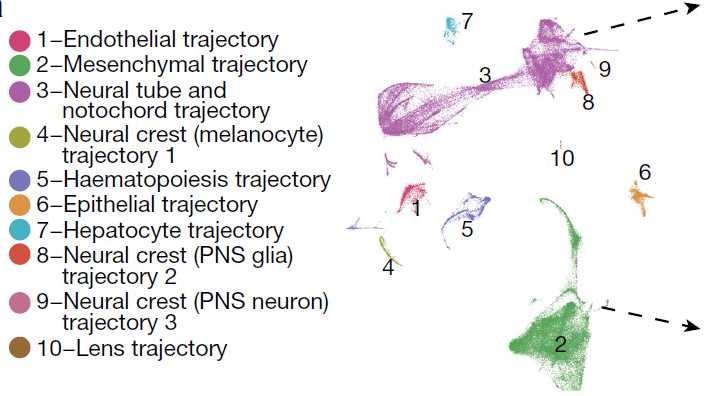
Monocle3 将1,524,792个高质量细胞(UMI大于400)分成12组轨迹,其中2组对应感知神经元和2组对应血细胞的分别合并,最终剩下10组(下图)。当中最复杂的为神经管-脊索轨迹(轨迹3,包括了脊索,神经管,神经和胶质细胞类型祖细胞和发育中细胞)和间质轨迹(轨迹2,包括所有间质和肌肉细胞类型)。此外还有3条神经嵴轨迹,分别对应感知神经元,Schwann 前体细胞和生黑色素细胞。造血轨迹(轨迹5)包括巨核细胞,红细胞和白细胞。剩下的4条轨迹(内皮,上皮,肝和晶状体)均对应一种主要的细胞类型。十大轨迹之间的不连续性可能是由于缺少中间细胞或是祖细胞等造成。随着发育进行,胚胎中来自不同轨迹的细胞的数量成指数增长,但各轨迹对应的细胞所占比例仍基本保持稳定,除了肝细胞,从E9.5的0.3%增长到E13.5时的2.8%
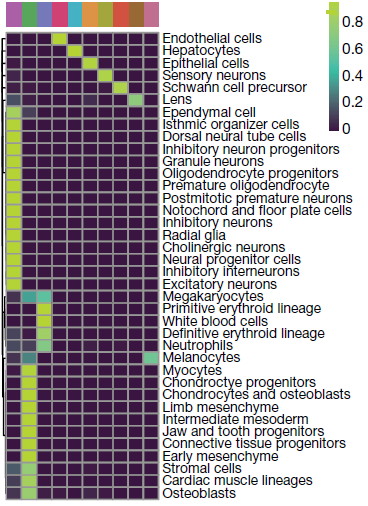
38个主类型基本上都仅归属于当中某一个组轨迹中(下图,颜色对应各类型细胞分到各组轨迹中的比例)
与t-SNE不同,UMAP能将相关的细胞类型放置在邻近的位置。比如在较晚发育节点发现的细胞类型如抑制性神经元,与早期中枢神经系统前体细胞(放射状胶质细胞)通过神经元前体细胞作“桥”相连,而相同的放射状胶质细胞,映射至另一方向,则是朝向成熟的少突细胞发展(下图上)(前述轨迹3);类似的,早期间质细胞辐射向着肌细胞,肢间质细胞,软骨细胞,骨细胞以及结缔组织发展(下图下)(前述轨迹2)
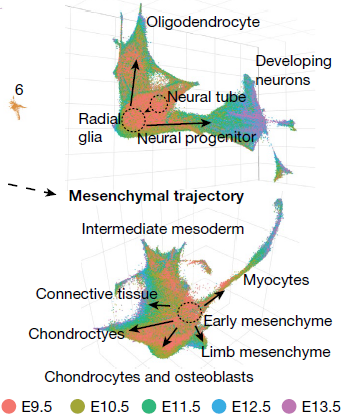
移除12%的细胞(为doublet或属于doublet分支)后,对上述10条主要轨迹进一步分析,结果如下图所示(主图中颜色对应亚轨迹名称,小图中则对应发育阶段)。可以看到,比如像上皮细胞轨迹,可以进一步分为多个不连续的亚轨迹,每一个都是从E9.5阶段细胞形成的局部聚集点出发,射向一至多个方向,对应后续时间点的细胞
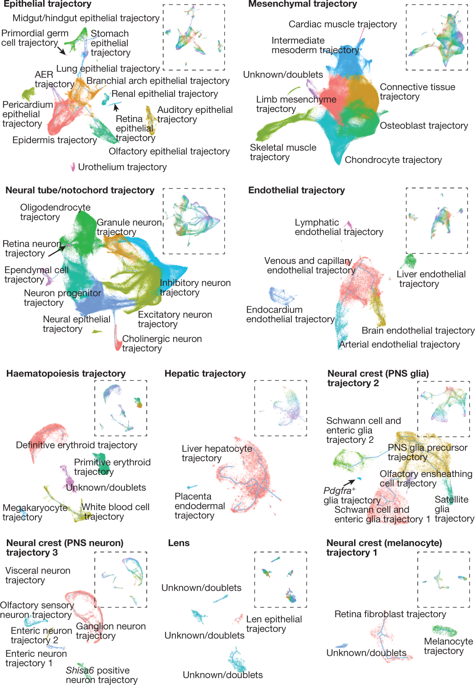
按照细胞亚型对亚轨迹进行着色(原文献 Extended Data Fig. 9),可以看到绝大部分亚型仅映射到单个亚轨迹上。对所有56条发育亚轨迹,基于对应的细胞亚型标志基因进行注释,发现这些发育轨迹覆盖所有主要的系统(原文献 Extended Data Fig. 10,如中枢神经,外周神经,呼吸,消化,心血管,免疫,淋巴,尿液,内分泌,表皮,骨骼,肌肉以及生殖等系统)。可以看到存在一些简单的线性轨迹,但绝大部分的轨迹存在分支,正如细胞类型可以通过多条平行通路生成。例如兴奋性和抑制性中枢神经系统神经元均可以通过多条收敛轨迹发育而来。另外也有像中间中胚层轨迹,在单个连续性结构内,存在多个起始和终止点
虽然 Monocle3 无法获得标签,但是亚轨迹与发育时间之间高度契合(即细胞按照E9.5-E13.5排列)。为了确定发育亚轨迹的方向,确认E9.5细胞局部聚集的一至多个点作为起始点,然后计算不同路径上细胞的发育拟时间(原文献 Extended Data Fig. 11),并基于这些信息注释细胞亚型。这些可以作为后续对572个亚型和56个亚分支进一步分析的起始
重构骨骼肌生成轨迹
发育中的肌肉包含多种E9.5之前形成的不同中胚层细胞系,因而以此为例深入探究发育过程。作者假设肌生成轨迹存在多个进入点,将细胞送入到同一路径中,该路径对应肌管之间共有的核心基因表达程序的活化
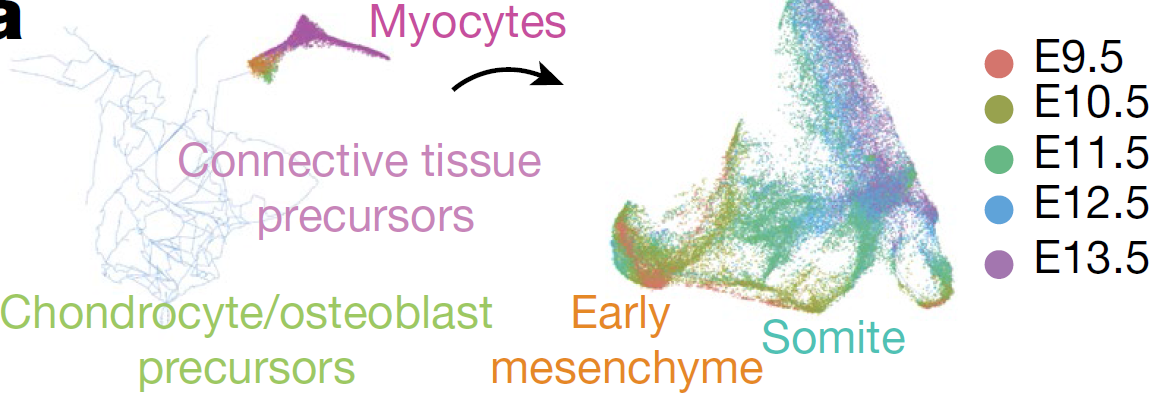
为了验证该假设,作者在计算分析时将肌细胞以及推断得到的其祖细胞从间质轨迹中分离出来,然后利用 Monocle3 构建了肌细胞特异性发育轨迹(下图),可以看到存在多个E9.5细胞的聚集区域,向外延伸出多条路径,分布着后续发育阶段的细胞
骨骼肌祖细胞标志基因 Pax3 和 Pax7 的表达分布十分广泛(下图)
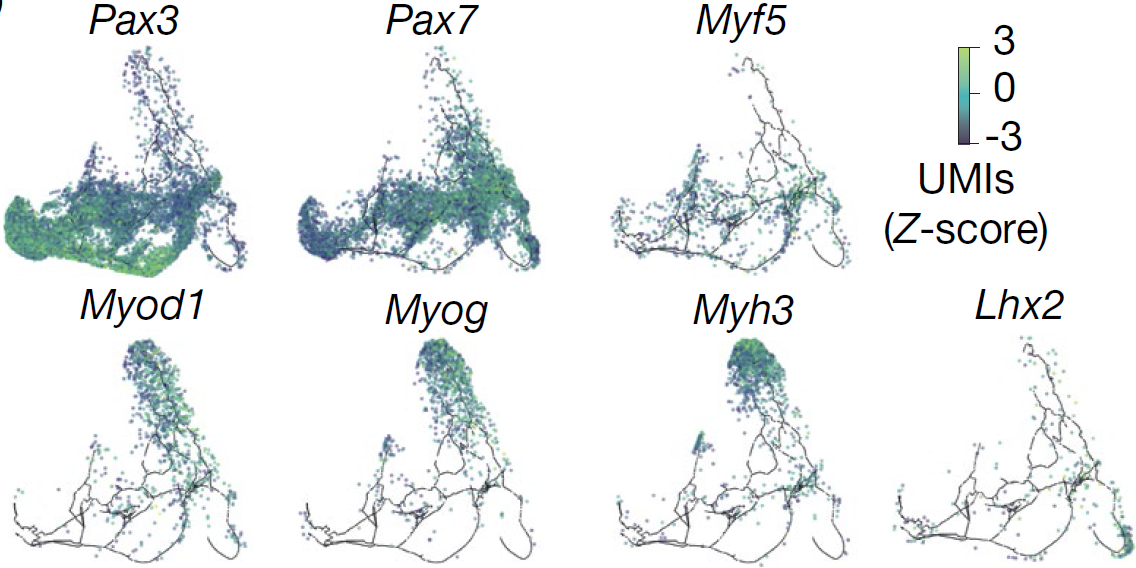
表达 Myf5 的细胞和一组 Pax7+ 细胞亚群共定位,与 Myf5 在胚胎肌生成过程发挥的作用一致;而从这片区域出发,存在两条平行的线性片段,细胞分别表达 Myf5 和 Myod1(下图),路径最终均终止于表达 Myog 或 Myh3 的细胞,后两者分别为肌细胞(myocytes)和肌管(myotubes)的标志基因。位于 Myf5+ 路径上的细胞,主要来自早期时间点,且高表达参与 Robo-Slit 信号通路的基因,该信号通路参与推动成肌细胞形成胚胎肌纤维。此外还有一部分E9.5期的细胞穿过一条表达 Lhx2,Tbx1 和 Pitx2,以及极少量的 Pax3 的路径,进入到 Myf5 和 Myod1 路径片段的上游,可能对应的是咽中胚层(pharyngeal mesoderm)
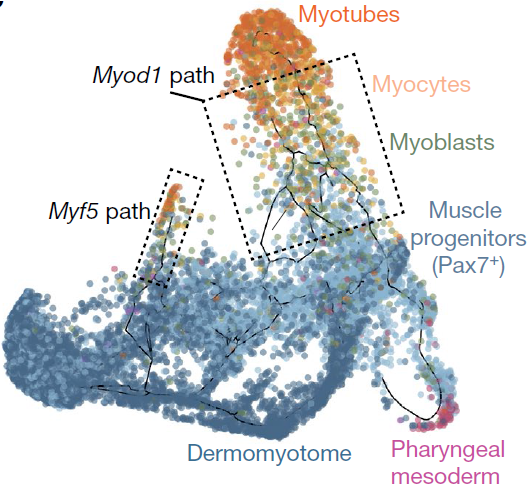
综上,整个肌生成轨迹与不同中胚层细胞系通过不同的因子最终汇聚于单个肌肉基因核心程序的观点相符。从整个轨迹中找出了2908个差异表达的基因,分为14个不同的模式
Discussion
MOCA 存在的不足之处:
- 测序未达到饱和,表达矩阵是稀疏的,但每个细胞几百条UMI也足以鉴定细胞类型,不一定非得上千条。测序的细胞数量和测序深度的取舍取决于具体的目标。整个实验对小鼠胚胎的覆盖度没有超过1X,因此有可能还是会遗漏一些极罕见的细胞类型
- 虽然作者认为注释的可靠性较高,但仍应将其视为较初步的结果。由于在单细胞水平,妊娠中期小鼠的发育还没被广泛地研究过,用到的一些标志基因特异性有限,此外也缺少像解剖结构信息等,后续还需要社区的共同努力以及其他如标志基因的原位分析等相互印证
最终的目标是能够建立起一个完整的,而且囊括时空信息的完整的发育图谱,为发育疾病等的研究提供帮助
REF
- Cao J, et al. The single-cell transcriptional landscape of mammalian organogenesis. Nature, 2019, 566(7745):496-502. doi: 10.1038/s41586-019-0969-x. Epub 2019 Feb 20.