肿瘤微环境(tumor microenvironment, TME)是由基质细胞构成的复杂系统。本文献中,作者对来自人类肺癌的52698个细胞进行单细胞转录组测序,并在独立样本的40250个细胞中进行了验证。通过与对应非恶性肺部样本的对比,揭示了 TME 的高度复杂性,以及其对基质细胞的塑造作用。
Introduction
肿瘤中,除了癌症细胞内存在高度的异质性外,肿瘤微环境(TME)本身也是一个复杂且高度异质的细胞生态系统。但是截至目前,对于该系统异质性的程度,以及它与肿瘤中其他细胞如何相互影响,我们仍知之甚少。
尽管如此,TME 越来越被认为是肿瘤治疗的靶标,在这之中,非小细胞肺癌(NSCLC)看起来是受益最大的一类肿瘤。例如,靶向 PD-1 或 PD-L1 的抗体能够激活细胞毒性 T 细胞的抗肿瘤功能,而在晚期 NSCLC 患者中,该疗法有效率达到45%,且部分应答非常持久。
scRNA-seq 技术的出现使得我们能够在单细胞层面对细胞群体的特征进行描绘,从而揭示各个单一类型细胞的变化。本文献中,作者对来自肿瘤和对应非恶性组织的细胞进行分析,揭示了基质细胞的异质性及其在肿瘤中的适应性。
非恶性肺部和肺癌中的细胞类型
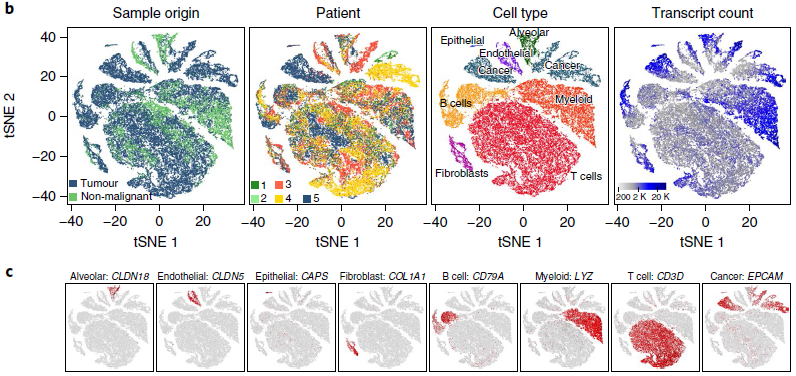
包括鳞状细胞(lung squamous carcinoma, LUSC)和腺癌(lung adenocarcinoma, LUAD)亚型在内的5位未经治疗,未转移的 NSCLC 患者为了治疗进行了肺叶切除手术。所有患者均有吸烟史,部分患有轻微的慢性阻塞性肺病(chronic obstructive pulmonary disease, COPD)。切除后,从同一肺叶上分别取3份肿瘤样本和1份非恶性肺部组织,并迅速进行单细胞测序。经过质控,获得52698个细胞(39323个来自肺癌,13375个来自非恶性肺部),共计约2000万条独特的转录本,有超过100个基因被检测到,整体的分布情况如下图所示。根据标志基因,可以很方便地确定8个大分支的身份,包括癌细胞,骨髓细胞,T 细胞,B 细胞,纤维母细胞,内皮细胞,肺泡细胞和上皮细胞。
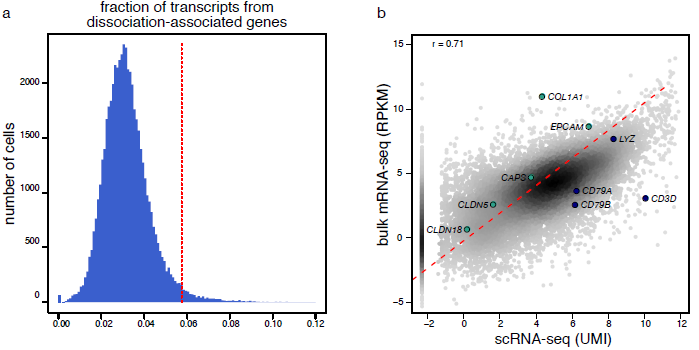
为了验证上述描述,作者同时还对1个肿瘤样本和非恶性样本进行混池转录组测序,发现总体而言,细胞分离过程并未对基因表达产生特别大的影响(下图左),混池测序中转录本数量与单细胞数据之间具有较好的关联性(下图右),当然也能看到细胞分支标志基因的表达存在不同。
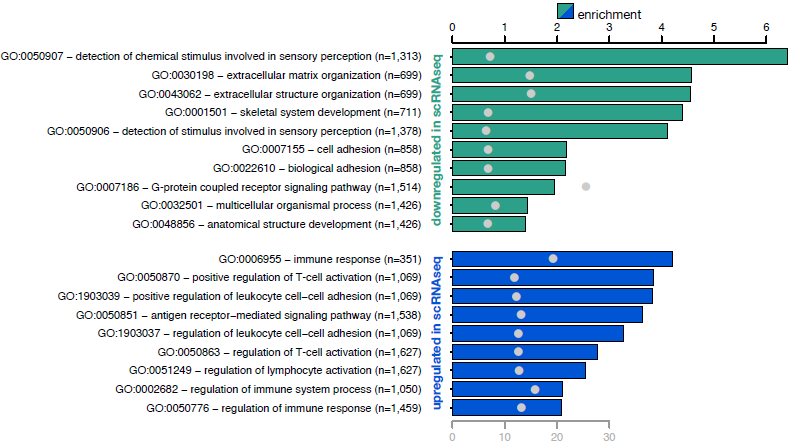
本体分析发现单细胞转录组数据香蕉混池转录组的差异表达基因在免疫相关过程中富集,但在上皮以及细胞外基质中缺失(下图)。
上述差异可能是由于不同类型细胞在分离效率上存在差异导致,因为纤维母细胞和内皮细胞相较免疫细胞更嵌入细胞外基质和基膜中,也就更难分离出来。为了估算每个细胞分支对混池转录组数据的相对贡献,作者用二次规划,确认肿瘤和非恶性样本中,淋巴细胞存在富集,肺泡细胞,纤维母细胞以及内皮细胞缺乏(下图)。
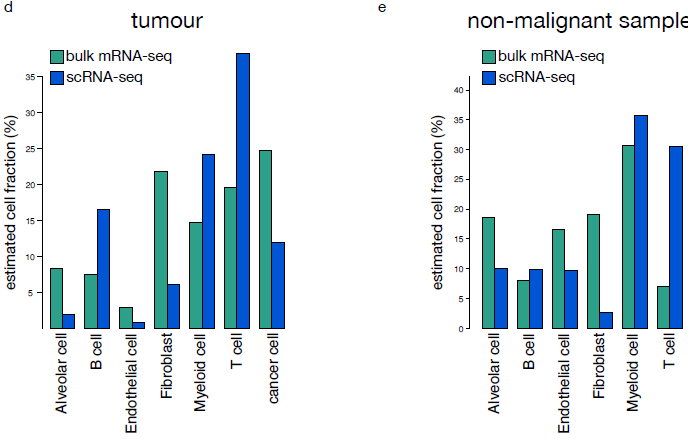
综上,虽然总体而言单细胞转录组成功复现了混池测序表达谱数据,不同细胞分离效率上的差异还是会对单个细胞类型产生影响。
作者对8大分支分别进行主成分分析,进一步寻找内部的亚型,最终鉴定出52种基质细胞亚型和12种癌症细胞亚型(下图)。对比不同病人,会发现肿瘤细胞类型呈现出高度的病人特异性,与体细胞多为肿瘤或病人特异性一致;而基质细胞分支中多包含多位病人的细胞。
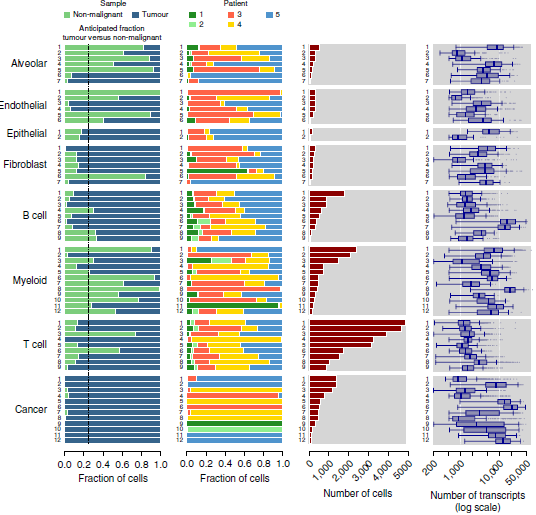
(所有细胞分支的整体概况)
从额外的3位 NSCLC 患者中获取的40250个细胞的数据找出了46/52的细胞分支,且不管是 LUSC 还是 LUAD,均含有多于10种的细胞类型。所有这些表明基质细胞并不存在强烈的个体间差异,而且52个细胞分支覆盖了肺癌 TME 中绝大部分的细胞异质性。
肿瘤内皮细胞下调免疫吸引通路
作者共找到1592个内皮细胞,进一步聚类后得到6个分支(下图)。
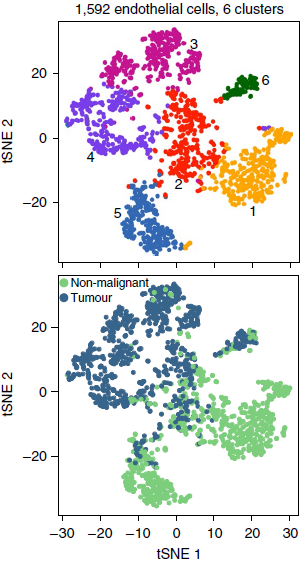
通过标志基因确定这些分支的类型,发现了在肿瘤和非恶性样本中均存在的一组淋巴管内皮细胞(分支6;标志基因 PDPN 和 POX1)和五组血液内皮细胞。血液内皮细胞中有两组主要存在于肿瘤中(分支3和4;IGFBP3+and SPRY1+),两组主要存在于非恶性组织中(分支1和5;MT2A+ and EDNRB+),剩下的哪一组包含低质量的内皮细胞(分支2;无标志基因),因此在后续分析时被剔除(下图)。
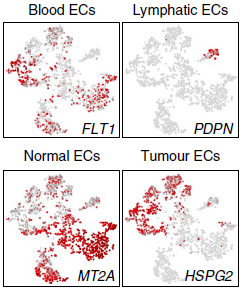
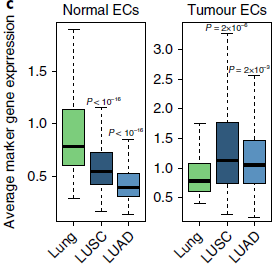
这些在另外3个病人的数据中也存在。另外,当对 TCGA 中的108个非恶性肺,501个 LUSC 和513个 LUAD 样本的混池转录组数据分析时发现,正常和肿瘤内皮细胞标志基因,分别在非恶性肺和肺癌中富集(下图)。
此外,基于分支3和5的标志基因 ACKR1 和 EDNRB,针对其他独立的肺癌和非恶性样本的免疫组化分析显示这些细胞构成分离的群体,分别在肿瘤和非恶性组织中富集。
对标志性通路的特征基因进行分析发现,虽然两类肿瘤内皮细胞间存在一定的差异,但相比之下,非恶性肺和肿瘤内皮细胞间的差异更大。直接对比两者,发现 Myc 靶标在肿瘤内皮细胞中富集程度最高。
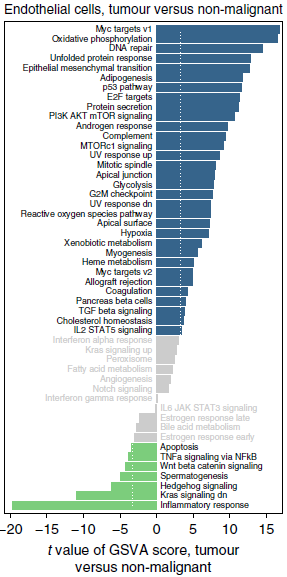
此外,肿瘤内皮细胞分支的 read 总数比正常内皮细胞高2-4倍,而且并不是因为 PCR 偏好性或者 RNA 降解酶表达量变化导致,说明肿瘤内皮细胞中转录速率上升(下图),而 Myc 已知能够普遍性上调转录,因此该现象可能是由 Myc 造成的,也意味着在肿瘤内皮细胞中抑制 Myc 的潜在价值。事实上,之前的研究表明 c-Myc 对肿瘤血管生成至关重要。代谢通路分析的结果进一步验证了转录需求的增加,因为增加最显著的通路参与核苷酸代谢,其他像参与氧化磷酸化和糖酵解等作为血管生成所必需的通路也受到了影响。
令人惊讶的是,下调最明显的通路参与炎症反应,更进一步的分析表明下调的基因涉及到免疫活化和免疫细胞归巢功能(下图),具体包括参与抗原提呈(MHCⅠ和Ⅱ),趋药性(CCL2, CCL18, IL6)和免疫细胞归巢(ICAM1)。内皮代表循环免疫细胞和肿瘤间的初级接口,在信号传递和抗原提呈中其重要作用。综上,肿瘤内皮细胞经过重塑,下调抗原提呈和免疫细胞归巢活性,导致肿瘤的免疫耐受。
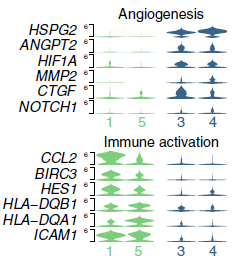
最后,作者用 SCENIC 分析导致正常和肿瘤内皮细胞间存在差异的转录因子,发现 MLX 和 MAF 可能是造成淋巴管内皮细胞基因表达差异的原因。这两个转录因子能够 下调 Fos/Jun 和 ELF3,上调 FLI1 和 TEAD1,看起来正好对应肿瘤特异性内皮细胞的表型(下图)。有趣的是,Fos/Jun 与内皮细胞中 ICAM1 的表达有关,而其他参与免疫活化的基因也被认为存在 Fos/Jun 结合位点,表明 Fos/Jun 的缺失导致肿瘤内皮细胞免疫刺激的表型减少。
肺癌中有5中不同类型的纤维母细胞
纤维母细胞一致被认为是异质性群体,但其异质程度一直未被搞清楚,因为其表型被认为是高度依赖周围环境,且在培养基中不稳定。本实验中,作者共检测到1465个纤维母细胞,并分为7个不同亚型(下图)。总体而言,相较非恶性肺部组织,纤维母细胞在肿瘤中富集程度并不明显(见之前所有细胞分支概况的图),但是其中分支1在肿瘤中高度富集,分支6则在非恶性样本中富集。所有分支均能至少在3位病人中发现,而且出分支7外均存在与额外的3位病人中。

各大分支在肿瘤和非恶性肺组织中的分布情况在 TCGA (下图)数据和额外3位病人中得到验证。基于分支2和6的标志基因 COX4I2 和 FIGF,对肺癌和非恶性肺组织进行免疫组化分析进一步确认了上述结论。
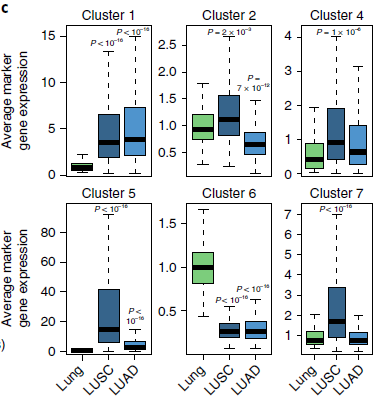
值得注意的是,每种类型的纤维母细胞都表达一种特定胶原和其他的胞外基质分子,例如分支1表达 COL10A1,分支2表达 COL4A1,而像非恶性纤维母细胞(分支6)高表达弹性蛋白,低表达部分胶原(Ⅰ,Ⅲ,Ⅴ和Ⅷ型胶原),不表达另一部分胶原(Ⅵ型胶原)。由于不同的胶原胞外基质中具有不同的功能,因此不同的纤维母细胞分支具有不同的功能。
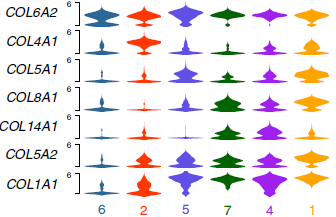
为了更进一步确定其功能,作者比较了通路的活性,发现存在显著的表型差异(下图)。肌成纤维细胞标志基因 ACTA2 在分支2中高表达,而该分支还高表达其他参与肌生成(MEF2C,MYH11 或 ITGA7),NOTCH 通路和血管生成的基因,表明这些细胞高度活化。分支5和7虽然由于均低表达肌生成特征基因,高表达 mTOR 特征基因而高度相似,但在糖酵解基因的表达上存在差异,表明代谢上的不同。另外,分支1和4也很相似,但是分支1呈现出明显的上皮-间叶转换信号,表达更多种类的胞外基质蛋白种类和 TGF-β 相关基因。
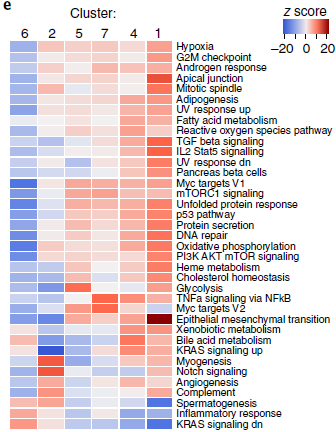
对比某个纤维母细胞分支和其他的分支,发现分支2中 MEF2C 和 ELK3 调控的基因高表达,而 FOXO1 和 MSC 调控的基因则低表达。已知 MEF2C 是一个肌生成转录因子,而 MSC 则是肌生成抑制因子,因此解释了分支2的肌生成表型。类似的,分支1中高表达 HOXB2 和 FOXO1 调控的基因,而编码细胞外基质蛋白的基因如 COL1A1,COL3A1 和 COL6A1 在其启动子附近存在大量推断的转录因子结合位点,这可能是分支1呈现出胞外基质表型的原因(下图)。

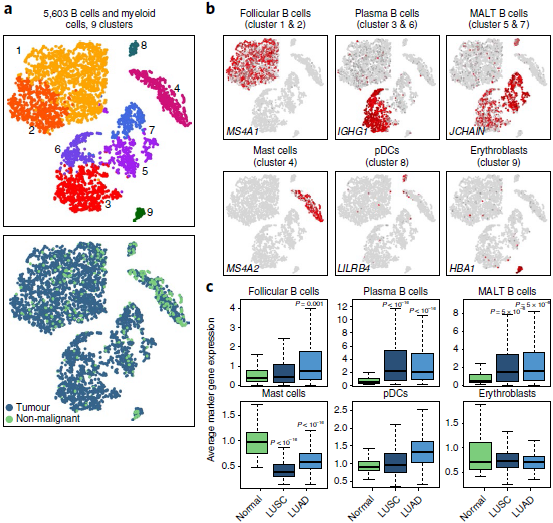
B 细胞在肿瘤中富集
作者共找到4806个 B 淋巴细胞和797个聚类在 B 细胞附近的细胞。B 细胞是肿瘤中富集最显著的基质细胞类型(见之前所有细胞分支概况的图),进一步聚类后发现存在9个分支,其中有6个分支在肿瘤中富集的程度尤其明显。滤泡 B 细胞(分支1和2)高表达 CD20(MS4A1),CXCR4 和 HLA-DRs;浆细胞(分支3和6)表达免疫球蛋白γ;粘膜相关淋巴组织来源(mucosa-associated lymphoid tissue-derived, MALT) B 细胞(分支5和7)表达 IgA,IgM 和 JCHAIN(下图)。
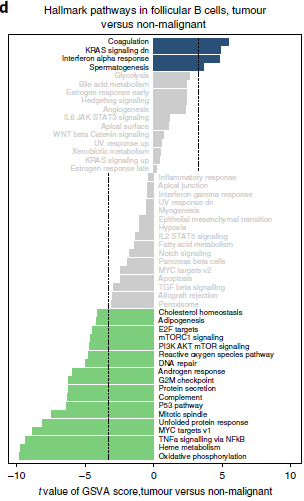
由于浆细胞不表达细胞增殖标志基因,因此无法排除当中是否存在成浆细胞。对比非恶性肺部和肿瘤中来源的浆细胞和 MALT B 细胞,并未从中找出通路上存在什么差异,不过非恶性肺部组织分离出来的细胞数量较少可能会影响统计效力。对于滤泡 B 细胞,发现肿瘤中氧化磷酸化,细胞增殖和生物大分子生成等通路(即与 Myc,mTOR 和蛋白分泌相关的通路)下调(下图);另外发现肿瘤中转录本数量相较非恶性肺部组织要少37.9%,与之对应。综上,肿瘤中滤泡 B 细胞呈耗竭状态。
其他与 B 细胞共聚的细胞对应 B 细胞谱系之外的免疫细胞:肥大细胞(分支4;表达类胰蛋白酶, KIT 和 MS4A2);浆细胞样树突状细胞(分支8;LILRB4+)和成红血球细胞(分支9;HBB+, ALAS2+ 和 SNCA+)。这些细胞并未呈现出肿瘤聚集性,且在 t-SNE 中或多或少难以区分肿瘤和非恶性肺部来源的细胞,表明肿瘤并未显著塑造它们。类似的,通路分析也没能找出明显的差异。
巨噬细胞呈现变阻表型并在肿瘤中 M2 激化
作者共找到9756个骨髓细胞,聚类后得到12个不同分支(下图)。分支7(S100A+)对应粒细胞,另外分支5(CD207+)对应朗格汉斯细胞,分支9(FCGR3A+, CYTIP+)对应单核细胞衍生树突状细胞,分支12(CLEC9A+ and XCR1+)对应交叉提呈树突状细胞,均属于树突状细胞。这些细胞在肿瘤中的丰度要低于其在非恶性肺组织中的,除了朗格汉斯细胞表现出近似的数量。另外8个包含 CD163+ 和 CD68+ 的巨噬细胞分支同样是在肿瘤中含量较低,而且呈现出更显著的病人和组织特异性(见之前所有细胞分支概况的图)。
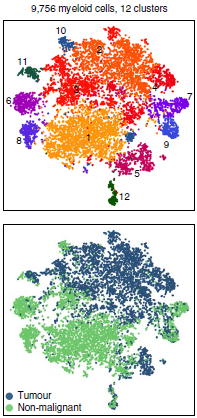
另外从上图也可以看到,不同分支之间其实分离并不显著,表明这些分支代表连续变化的不同细胞状态,与巨噬细胞活动的谱系模型一致。另外针对分支1,2,3的标志基因分析也没能够找到特异性表达的基因。
不过从图中我们可以看到肿瘤和非恶性肺组织来源的细胞之间存在明显的划分,而当比较两者之间通路表达水平时,发现肿瘤来源的巨噬细胞中,炎症反应,TNF-α 诱导的增殖和活性氧生成通路表达显著下调,以上均为小鼠癌症模型中所描述的 M2 样,巨噬细胞肿瘤前亚型的标志(下图)。
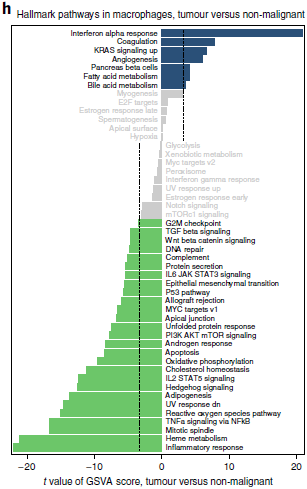
SENIC 结果发现 IRF2, IRF7, IRF9 和 STAT2 转录因子调控的基因在部分肿瘤巨噬细胞中表达上调,而 Fos/Jun 和 IRF8 调控的基因则表达下调(下图)。在巨噬细胞中,IRF2 起免疫抑制作用,而 Fos/Jun 则能增强巨噬细胞的炎症反应,IRF8 推动 M1 计划。综上,人类肿瘤中巨噬细胞呈现 M2 极化状态,并找到了一些可能是导致这些变化的转录因子。

肿瘤 T 细胞转录组数据展示潜在的免疫治疗靶点
作者共找到24911个 T 细胞,进一步分为9个分支(下图),包括调节 T 细胞(分支7;FOXP3+),自然杀伤细胞和自然杀伤 T 细胞(分支6;FGFBP2+),CD8+ T 细胞(分支2,4,5,8;CD8A+),CD4+ T 细胞(分支1,3,9;CD4+)。另外在分支2中,还发现存在一小簇的固有淋巴Ⅰ型样细胞和 γδT 细胞。
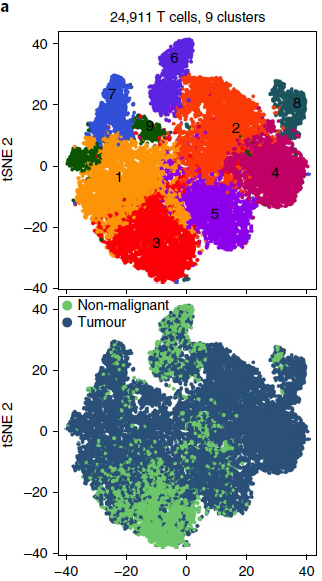
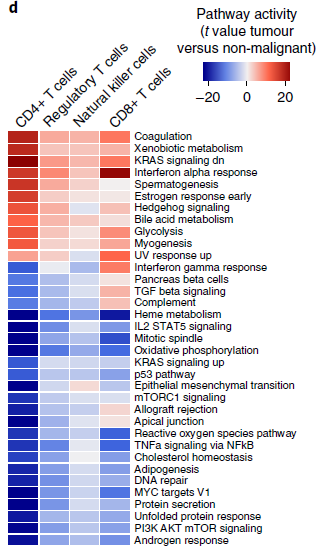
除了分支4主要来源于一位病人外,所有分支均能在所有病人中找到。CD8+ 和调节 T 细胞在肿瘤中富集,而除了 CD4+ T 细胞分支9仅在肿瘤中表达外,CD4+ 和自然杀伤细胞则缺乏。T 细胞分支在肿瘤或非恶性肺组织中的富集表明肿瘤对 T 细胞转录组有着巨大影响,进而对比两者通路表达情况,发现存在一些普遍性的变化,,包括糖酵解增加,氧化磷酸化下调。此外,除了分支8的肿瘤特异性增殖 CD8+ T 细胞,其他肿瘤 T 细胞的细胞增殖通路下调(下图)。
当然,不同类型的 T 细胞之间,部分通路的调控也存在差异。对于 CD8+ T 细胞(下图),发现分支8为高度增殖性(有丝分裂,G2M 检查点,E2F 靶标);分支4和8具有高水平的同种异体移植物排斥活性,可能是对肿瘤细胞编码的新生抗原表现出更强的反应。另外,这两个分支均具有更强的 IFN-γ 和 IFN-α 反应性,更快的转录速率,Myc 活性和高颗粒酶表达,均为 T 细胞活化特征。
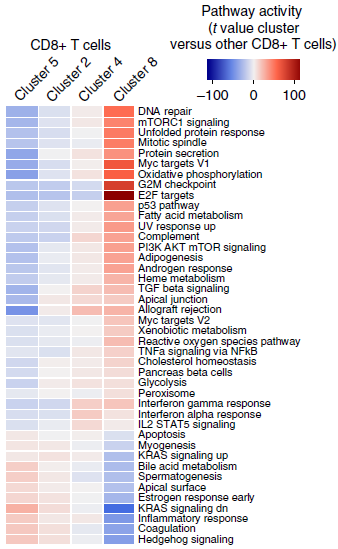
此外,它们高水平表达免疫检查点分子(下图),包括已被证实的靶点如 PDCD1 和 CTLA4,以及目前还处于临床试验阶段的,如 LAG3, TIGIT, HAVCR2/TIM3, CD27 和 TNFRSF9/CD137。
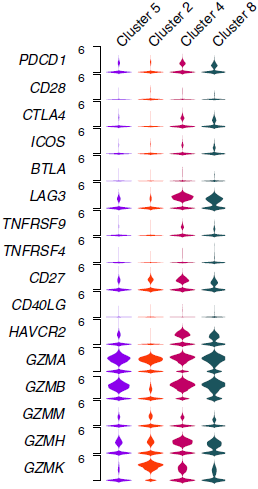
根据颗粒酶(GZMA, GZMB 和 GZMH)的平均表达量计算,这些分子与 T 细胞活性相关,表明由于高检查点表达量导致细胞毒性活性被抑制。作者还确定了另外与颗粒酶呈现出类似关系的分子(下图),可能代表新的检查点分子。

另外,CD8+ T 细胞中其他与高同种异体移植物排斥活性相关的通路包括增强的氧化磷酸化和脂肪酸氧化,表明靶向针对这些通路可能有助于免疫治疗。恰好,最近有一项研究表明在 CD8+ 肿瘤浸润 T 淋巴细胞中促进脂肪酸代谢能加强他们减缓肿瘤进程的能力。
肺泡和上皮细胞
肺泡由多种类型细胞组成,是正常肺组织的重要组成部分。之前有一项针对198个小鼠肺泡细胞的单细胞转录组研究,本文献中找到的1710个人类肺泡细胞除了重现了许多小鼠肺部存在的标志基因外,还找到了一些人类特有的细胞类型和标志基因。,包括扁平肺泡Ⅰ型(AT1)细胞(分支3;AGER,CAV1),分泌表面活性物质的立方肺泡Ⅱ型(AT2)细胞(分支 1;SFTPC,ABCA3),分泌棒状细胞(分支6;SCGB1A1),以及之前未发现的基底细胞(分支7;KRT15)。基底细胞标志基因在 LUSC 中高表达,但在 LUAD 中并没有。此外,作者还找到了表达 COPD 诱导的受伤标志基因的细胞(分支4;MMP7,CXCL14,GDF15)和呼吸上皮细胞(分支5;CYP4B1)。
如预期的一样,AT1,AT2 和 呼吸上皮细胞几乎只在非恶性肺组织中存在,这在额外的40250个细胞以及 TCGA 数据中得到了验证。令人惊讶的是棒状细胞常出现在肿瘤组织中,其对肺癌有无作用以及如何作用需要进一步的研究。
特定基质细胞亚型聚集在含氧量更高的肿瘤边界
缺氧与肿瘤多种行为相关,包括血管生成,转移,代谢重编程以及免疫逃脱等,因此作者想看看有没有哪些亚型更多地定居在肿瘤的低氧区域。分别从肿瘤最中心,最边缘以及中间区域获取样本,根据缺氧特征基因集估算缺氧水平。为避免干扰,仅对癌细胞进行分析。结果显示,肿瘤中心区域聚集更多的肿瘤细胞,相较边缘的样本含氧量更低(下图)。HIF1α 和 缺氧标志 CA9 的免疫组化验证了该结果。
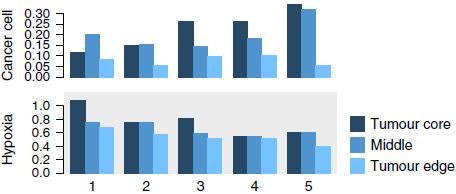
绝大部分基质细胞亚型在含氧量正常的肿瘤边缘聚集(下图),如 CD4+ T 细胞分支1,CD8+ T 细胞分支5,滤泡以及 MALT B 细胞等。
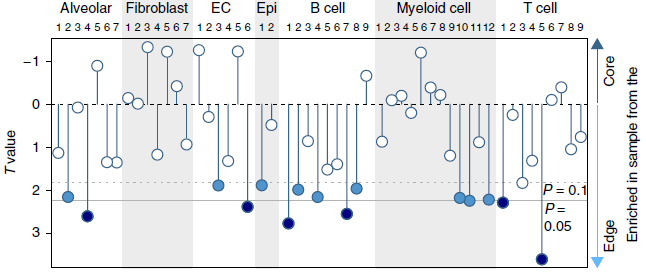
基质细胞亚型与肿瘤特征之间的关联
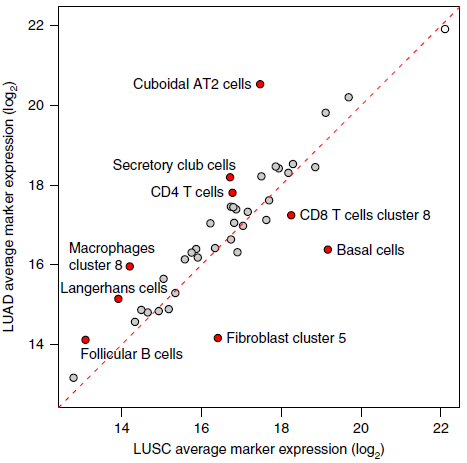
作者对标志基因表达与肿瘤组织学以及状态等特征之间的关系进行了探究,发现42种细胞亚型中,只有9种在 LUAD 和 LUSC 之间呈现出差异(下图)。对于其中2种亚型,表达上的差异可能反映了肺癌细胞的起源:LUAD 来源于 AT2 细胞,LUSC 来源于基底细胞。对于另外7种亚型,例如 CD8 T 细胞分支8和纤维母细胞分支5,关联性可能反映了组织病理学上的差异。至于所处阶段,鳞癌中许多基质细胞成分减少,处于更晚期,而腺癌中鲜有状态相关的变化。
考虑到变异负荷与肿瘤抗原性之间的关联,作者对标志基因与突变负荷之间的关系进行了探索,发现 CD8 T 细胞分支8的标志基因与突变负荷呈正相关,而其他基质细胞标志几乎都导致更低的突变负荷。这可能反映了变异识别过程中存在的问题:非癌症细胞比例的增加会导致体细胞突变等位基因频率降低,使得它们更加难被检测出来。类似的情况在分析与 TP53 或 RAS(KRAS, HRAS, BRAF)等变异时也存在。
有趣的是,EGFR 变异在 LUAD 中与 CD8+ T 细胞分支2呈负相关,但与纤维母细胞分支6正相关。最近有研究发现 CD200+ 肿瘤相关纤维母细胞亚群会增强 gefitinib 对 EGFR 变异的肺癌的凋亡作用。另外,分支6的正常纤维母细胞相较分支1,4,5,7会表达更低水平的 CD200。以上表明纤维母细胞分支6赋予了 EGFR 变异肺癌选择性生长优势。
LUSC 中高基质标志基因表达对应更低的存活率,而 LUAD 中则没有该关联
对总计1027个 LUAD 和545个 LUSC 样本分析,发现 LUSC 中基质标志基因表达的增加与应存活率的下降之间存在一惯性的关联,而 LUAD 中则没有(下图)。
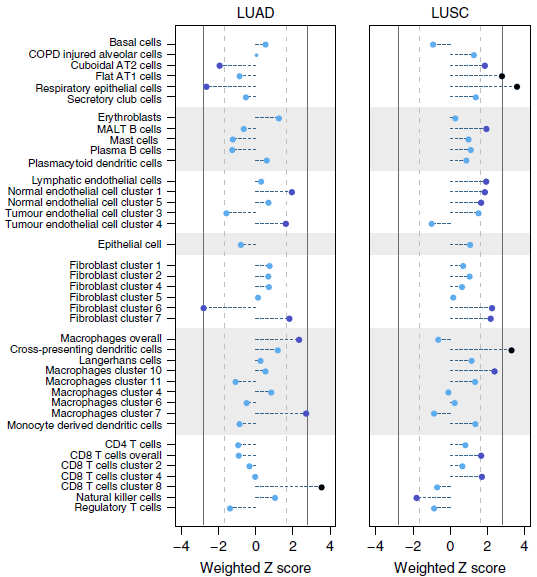
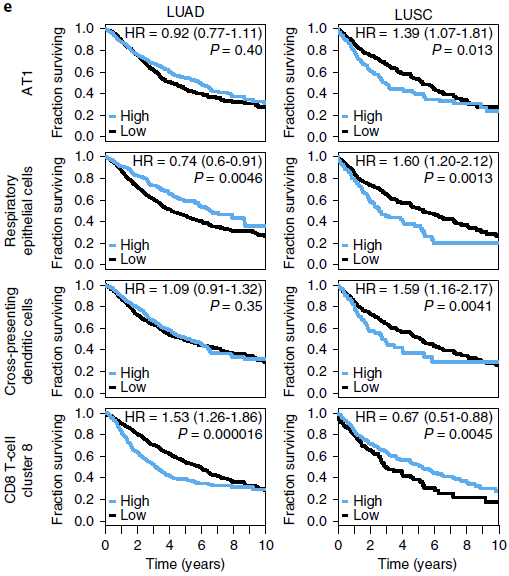
另外,部分细胞亚型在不同肺癌中与存活率呈现出相反的关联性(下图)。
Discussion
整个研究中,作者在单细胞层面对人类肺癌和非恶性肺组织的基质细胞进行了详细的描述。除了验证了之前研究的一些结论外,还找到了新的细胞亚型,变化的通路,基质信号的细胞来源,并对标志基因进行编目,有助于未来肺癌的诊断和治疗。
从研究结果来看,肺 TME 要比我们之前预计的更加复杂。针对92948个细胞(84341个基质细胞)的分析共找到52个不同的基质细胞亚型,它们相互之间以及在肿瘤和非恶性组织之间呈现出不同的通路活性。但是,这些亚型是否真的是独立的细胞类型,还是只是由于对 TME 刺激应答而表现出的状态还有待进一步的探索,比如通过谱系追踪的方法等。
在所有分支中,绝大部分都有来源于多位病人的细胞,而且针对额外3位病人的分析也找到了其中的45种。但是,对 TCGA 数据中标志基因的分析发现部分细胞亚型在 LUSC 和 LUAD 中的丰度不同,意味着它们受到肿瘤所处阶段等特征的影响。此外,部分基质细胞亚型仅在 LUAD 或 LUSC 中与存活率之间存在关联。以上这些表明虽然绝大部分基质细胞亚型在肿瘤中普遍存在,但是其数量和功能在不同肿瘤间存在差异。此外,这些亚型在其它类型的肿瘤,或者是肺癌转移至其他器官形成的肿瘤中是否也存在。
在鳞癌中,许多基质细胞标志基因与存活率呈负相关,但这种关系是否真实还需进一步的验证。肿瘤中基质细胞数量能够反映癌症细胞的侵袭性:侵袭性越强的肿瘤拥有更多的基质细胞。此外,在多个队列中,部分标志基因与存活率都存在明显的关联,意味着它们可能可用于预后的生物标志以及对治疗效果的预测标志。
最后,肿瘤基质细胞中基因表达的变化暗示着可能的治疗方向,这些基质细胞不同的特征意味着新疗法设计的切入点。
REF
- Lambrechts D, et al. Phenotype molding of stromal cells in the lung tumor microenvironment. Nat Med. 2018 Jul 9. [Epub ahead of print]. doi: 10.1038/s41591-018-0096-5.