对肿瘤微环境中免疫细胞表型的研究有助于我们理解肿瘤发展和免疫治疗应答的机制。
Introduction
最近的研究表明免疫细胞在非淋巴正常组织以及肿瘤中都起着重要的作用。虽然靶向 CTLA-4 和 PD-1 等的免疫疗法在治疗黑色素瘤,肺癌以及肾癌等取得了巨大的成功,但是,并非所有的癌症,以及所有的病人都能从免疫疗法处获益。这种治疗效果上的差异被发现与各个肿瘤的免疫细胞组成的异质性有关,这就给我们提出了问题:正常和肿瘤组织在免疫细胞的状态上是否存在差异;它们代表的是有限数量的离散状态,还是一个连续变化图谱中的某几个点。本文献中,作者对人类肿瘤组织以及相应正常组织,外周血和淋巴结处的组织进行了大规模的分析,发现肿瘤中淋巴系和骨髓系细胞的异质性均显著增加,表型空间也扩大。
Result
作者从8位未经过治疗的各种亚型的病人的原位癌组织中收集了47016个 CD45+ T 细胞,以及对应正常乳房组织,外周血和淋巴结收集得到的 CD45+ T 细胞进行了测序。首先使用 PhenoGraph 进行聚类,并基于各分支平均表达水平,之前研究确定的免疫细胞转录表达谱和经典标志基因对各分支进行注释,从中找出了大部分预期存在的免疫细胞类型,如单核细胞,巨噬细胞等,表明确实成功从各个肿瘤中得到了免疫细胞的完整图谱。与之前的研究结果一样,可以看到每个肿瘤的免疫细胞组成差异很大,且病人之间代谢特征也存在差异。
为了在病人之间进行一个系统性的比较,作者将来自所有肿瘤的数据进行了整合,发现来自同一病人的细胞相较不同病人同一细胞系的细胞更相似,这可能是由于批次效应以及常规标准化过程将生物学信号和技术差异混合导致的。为了排除技术因素带来的影响,作者用改进后的 Biscuit 对整合后的数据重新进行聚类,并基于熵测量值量化样本的混合情况,发现 Biscuit 标准化确实显著提升了病人间细胞的混合,表明免疫细胞确实存在多样性。
将所有病人和组织的数据整合,作者共计找到83个分支。绝大部分分支存在于多位病人中,只有10个分支是某一病人特有的。通过熵值对病人特异性进行量化,发现分支间病人混合程度差异较大。基于已分类的混池数据,以及经典标志基因,鉴定出各分支的身份。
具有较多分支的细胞类型仅依据较少数量的表面标志基因确定,因此为了进一步准确区分这些分支,作者在全基因组层面,基于平均表达以及共变化模式(即基因之间的共表达)进行了分析,成功确定了多种亚细胞群。
为了量化免疫表型的差异有多少是由其所在组织导致,作者通过 t-SNE 图来可视化不同组织间表型间的重叠度,发现血液和淋巴结中 T 细胞的表型与乳腺组织中的存在不同(下图左为所有细胞,右为根据组织不同绘制的同一坐标轴上的图)。可以看到,虽然 T 细胞和骨髓细胞在肿瘤和正常组织间呈现出一定的重叠性,但是在肿瘤中,表型的异质性以及范围明显要大得多。以上结果表明免疫细胞所在的组织是决定其表型的一个重要因素,也意味着我们基于血液免疫细胞的生物标志物可能无法准确反映肿瘤中免疫细胞的组成情况。
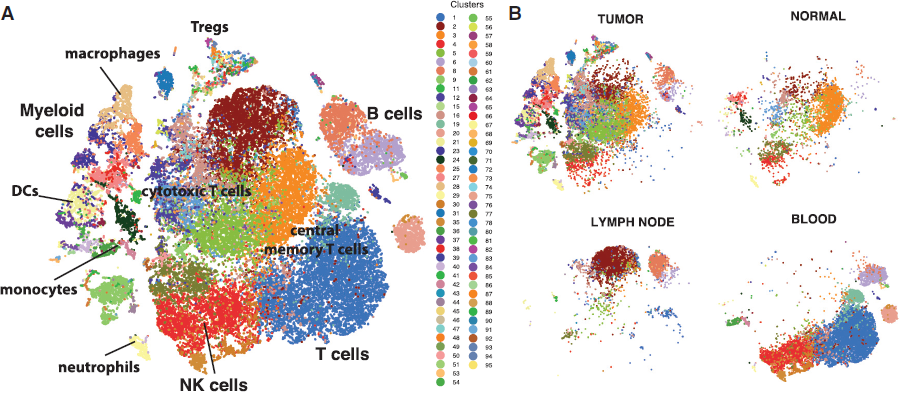
作者发现肿瘤组织相较正常乳腺组织多了不少种免疫细胞状态,而正常组织中不存在其独有的分支,这种细胞状态多样性的增加是由于肿瘤与正常组织间基因表达的差异增加导致的,其中差异最显著的基因富集于肿瘤微环境中激活的信号通路,包括 type I (IFNα) and II interferons (IFNβ), tumor necrosis factor alpha (TNF-α), transforming growth factor β (TGF-β), IL6/JAK/STAT signaling, and hypoxia。
为了进一步探索变异增加的原因,作者定义了表型体积(phenotypic volume)这一衡量标准。通过基因表达的协方差来衡量单个表型所占的体积,从而比较肿瘤和正常组织中各个细胞类型所占据的表型体积,结果发现肿瘤中所有主要细胞类型,如 T 细胞,骨髓细胞,NK 细胞等表型体积相较正常组织均显著增加,意味着肿瘤中细胞状态的异质性以及表型类别的显著扩大可能是由于肿瘤中更多样化的局部微环境导致,包括炎症程度,缺氧,营养提供等。
作者利用 diffusion maps 分别对 T 细胞和骨髓细胞进行分析,希望确定影响表型变异最显著的因素。可以看到,分的分支呈现出逐渐变化的趋势(下图),其中最相关的三大因素分别与激活,终末分化以及缺氧等特征相关。其中,激活作为影响最大的那个,与 T 细胞激活,渐进分化以及 IFNγ 等基因高度相关。激活相关特征基因的平均表达水平在各分支间是逐渐变化的,肿瘤内 T 细胞如 Treg 和效应记忆 T 细胞等活化水平高的一侧,而初始外周血 T 细胞则聚集在另一侧。类似的,在终末分化方面,各分支的表现亦是如此。以上结果表明,T 细胞的激活呈现出大范围的连续状态,过往我们将其归为少数几种离散的状态可能过分简化了组织中 T 细胞表型的复杂性。
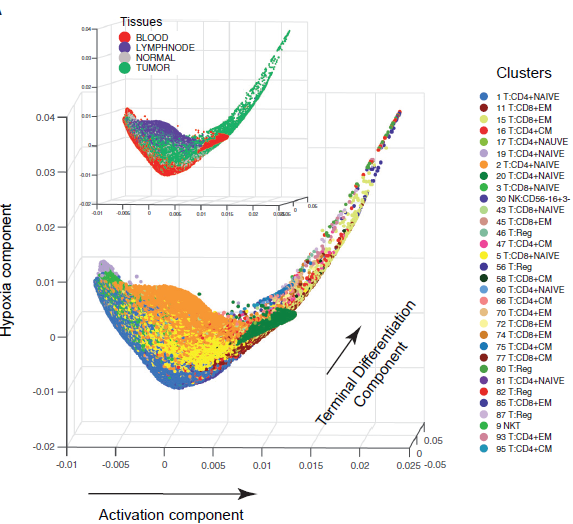
从之前的结果来看,影响差异的最主要因素仍不能完全解释分支间的不同,因此作者依照激活相关基因表达水平,将各分支连续排列,发现不同分支在与不同环境刺激的应答相关的基因的表达情况上存在差异,表明肿瘤中的 T 细胞可能暴露于不同程度的炎症,缺氧以及营养匮乏条件下。这些响应单独来看呈现出连续变化的模式,但它们的组合可能导致相对更离散化的状态。
与效应 T 细胞不同,Treg 各分支在抗炎症,耗竭,缺氧以及代谢基因集上呈现出相似的模式。为了确定区分 Treg 的特征,作者检查了 Biscuit 区分它们的参数,发现不同分支共表达情况存在差异。平均表达量有时候会误导我们,例如两个分支中,两个基因的平均表达量相似,但实际上,一个分支中这里两个基因常常共表达,呈正相关,而另一分支中两个基因则是互斥表达,呈负相关,因此不同分支中这些基因的共表达情况存在差异。Treg 各分支中,检查点受体的共表达特征存在差异;其他重要的免疫基因则呈现出模块化的协方差结构,表明这些基因存在共调控以及可能参与相似功能。另外,由于不同病人 Treg 分支组成比例不同,因此在病人水平,基因共表达情况也存在差异。因此,基因的共变化在定义 T 细胞分支,尤其是 Treg 各分支中发挥作用。
之前提到肿瘤内 T 细胞激活状态差异的连续性可能是由于不同微环境导致的,另一种假说则是由于不同的 TCR 组成,导致信号强度变化范围大,进而导致 T 细胞激活状态的连续性变化,掩盖了转录状态。为了证明是否真是这个原因,作者从另3个乳腺癌肿瘤中分选出超过27000个 CD3+ T 细胞进行 scRNA-seq 和 V(D)J 测序。为了评估 TCR 多样性所能解释的比例,作者基于相互对应的单细胞转录组和 TCR 测序数据绘制了各个克隆型的激活状态,发现部分克隆型呈现出不同的平均活化水平,而且每个克隆型活化状态的分布明显受到了限制(相较于随机取样,熵值更低),意味着TCR多样性能够部分解释 T 细胞活化状态的差异,也意味着还有其他的因素在起作用。
各个分支由不同的 TCR 克隆型组合子集构成,进一步支持各个分支的不同部分是由于 TCR 导致。此外,每种克隆型仅存在于少数相关的分支中,因此其在 t-SNE 图上上占据的区域较小。有些共享某一克隆型的分支呈现出相似的活化水平,另一些则是在与环境刺激更相关